SEPARUH PENGALIR
Sebelum kita mendalami tentang SEMIKONDUKTOR mari kita kenali dahulu tentang struktur atom.
Semua benda di dunia ini samada pepajal, cecair atau gas terdiri daripada berjuta-juta atom. Contoh: air terbentuk daripada gabungan atom hidrogen dan atom oksigen. Setiap atom terdiri dari tiga partikel asas, iaitu Proton, Neutron dan Elektron. Proton dan Neutron berada di dalam Nuklius sedangkan Elektron berada di orbit sambil mengeliling Nuklius.
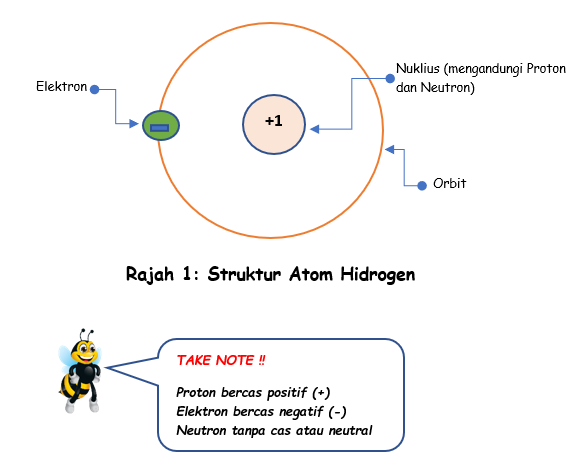

Apa itu Elektron Valens?
Elektron valens ialah elektron yang berada pada lapisan paling luar sekali iaitu lapisan valens. Bilangan elektron valens yang terdapat pada lapisan ini tidak lebih dari 8.
Jika sesuatu atom mempunyai 1 hingga 3 elektron valens, bahan ini dianggap pengalir (konduktor) kerana atom-atomya lebih cenderung untuk melepaskan sahaja elektron-elektron valensnya dan menjadi elektron yang bebas bergerak dari satu atom ke atom yang lain.
Tetapi jika terdapat sesuatu atom yang mempunyai 5 hingga 8 elektron-elektron valens, maka bahan ini dianggap penebat (insulator) kerana atom-atomya cenderung untuk memenuhkan lapisan valensnya supaya stabil dengan cara menerima elektron-elektron lain masuk ke orbitnya.
Jika sesuatu atom mempunyai 4 elektron valens, ia tidak mudah melepaskan atau menerima sebarang elektron. Jadi bahan ini dipanggil separuh pengalir atau Semikonduktor. Germanium (Ge) dan Silikon (Si) adalah bahan semikonduktor kerana masing-masing mempunyai 4 elektron valens. Ia tidak akan mengalirkan arus semudah pengalir dan tidak pula menghalang pengaliran arus semudah penebat.
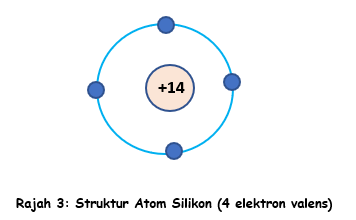
Ia mempunyai 3 lapisan. Lapisan pertama (Lapisan K) terdapat 2 elektron, lapisan kedua (lapisan L) terdapat 8 elektron dan lapisan ketiga (lapisan M) terdapat 4 elektron. Rajah di atas ditunjukkan satu lipasan terakhir dan elektron valens sahaja.
Sebenarnya setiap dari satu dari empat elektron valens akan ‘berpasangan’ dengan satu elektron dari atom jirannya. Ini akan mewujudkan satu ikatan yang kuat yang menjadikan atom-atom itu teguh. Pasangan elektron-elektron ini disebut Ikatan Kovalen.
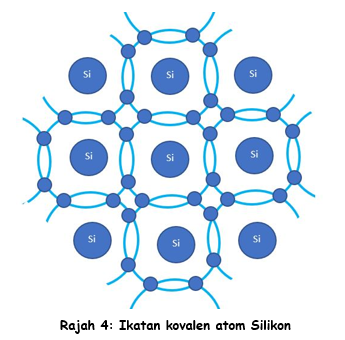
Merujuk kepada Rajah 4 di atas, didapati setiap atom seoalah-olah mempunyai 8 elektron valens. Ini menunjukkan setiap atom itu stabil.
Walaubagaimanapun atom ini boleh jadi tidak stabil jika berlaku kenaikan suhu atau faktor haba. Ketidakstabilan menyebabkan elektron terbebas dari orbitnya (terlepas dari ikatan kovalen).
Dalam keadaan sejuk keteguhan ikatan kovalen adalah dalam keadaan terbaik. Jika berlaku kenaikan suhu akan ada elektron-elektron yang terlepas adari ikatan masing-masing. Elektron-elektron yang terbebas akan bergerak berpindah-pindah dari satu orbit ke orbit atom lain.
Begitu juga jika voltan yang tinggi dikenakan merentasi bahan tersebut, ia juga boleh membuatkan elektron akan terbebas. Elektron-elektron akan tertarik kepada keupayaan positif.
Satu lagi cara untuk membebaskan elektron-elektron dari ikatan-ikatan kovalen ialah melalui proses serapan (dopping).
Elektron Bebas dan Hol Sebagai Pembawa arus
Merujuk Rajah 5 elektron yang terbebas dari ikatan kovalen dipanggil Elektron Bebas. Elektron-elektron bebas merupakan pembawa-pembawa arus. Oleh kerana elektron bercas negatif, maka elektron bebas dikenali sebagai Pembawa Arus Negatif

Apabila elektron terlepas dari ikatan kovalennya, ia akan meninggalkan ruang kosong yang dipanggil Hol (hole) atau Lubang. Ketiadaan elektron ditempatnya bermakna tiada cas negatif, iaitu maksudnya ruang itu telah menjadi cas positif. Hol yang bercas positif juga merupakan pembawa arus, ia dipanggil sebagai Pembawa Arus Positif
Elektron-elektron bebas mempunyai kecenderungan untuk mencari hol-hol, sementara hol-hol mempunyai kecenderungan untuk menarik elektron-elektron bebas. Masing-masing bertujuan untuk membentuk semula ikatan kovalen.
Keujudan elektron bebas dan hol-hol dalam semikonduktor merupakan sumbangan terhadap pengaliran arus elektrik jika suatu beza upaya (voltan) merentas bahan tersebut.
Pergerakan Arus
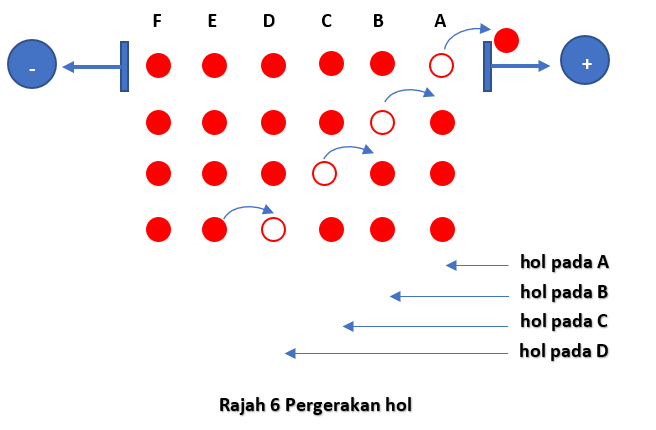
Kita telah memahami bahawa terdapat dua jenis pembawa arus iaitu elektron bebas dan hol. Apabila terdapat voltan dikenakan merentas bahan semikonduktor, pembawa-pembawa arus ini akan bergerak . Pergerakan elektron-elektron bebas ini ialah dari terminal negatif menuju ke terminal positif sesuatu keupayaan. Hol-hol juga bergerak, tetapi bagaimana?
Sewaktu elektron-elektron mengalir kerana ditarik oleh keupayaan terminal positif, perjalanannya adalah secara melompat dan terkeluar dari satu hol ke satu hol sebagaimana yang ditunjukkan di dalam rajah di bawah.
Proses Serapan
Semikonduktor Intrinsik dan Ekstrinsik
Hablur Germinium dan Silikon adalah semikonduktor tulin yang tiada sedikitpun mengandungi unsur bendasing di dalamnya. Hablur ini dinamakan semikonduktor jenis Intrinsik. Semikonduktor jenis ini tidak mempunyai sebarang keistimewaan.
Bagaimanapun jika semikonduktor tulin dicampur dengan bahan lain, ia menjadi tidak tulin lagi. Ia dipanggil semikonduktor jenis Ekstrinsik. Ia lebih bermanfaat. Hampir keseluruhan komponen-komponen semikonduktor diperbuat dari semikonduktor ekstrinsik.